 Tendo como base o tema de 2016 da Semana Nacional de Ciência e Tecnologia (SNCT) "Ciência Alimentando o Brasil", o UFABCiência e o Prof. Dr. Paulo de Ávila Jr., coordenador do projeto de extensão “Bioquímica nos alimentos e introdução à educação alimentar”, lançam uma série de textos que relacionam conhecimentos científicos aos alimentos. O primeiro texto parte de um conhecimento popular para analisar o impacto de uma combinação alimentar na absorção de ferro pelo organismo.
Tendo como base o tema de 2016 da Semana Nacional de Ciência e Tecnologia (SNCT) "Ciência Alimentando o Brasil", o UFABCiência e o Prof. Dr. Paulo de Ávila Jr., coordenador do projeto de extensão “Bioquímica nos alimentos e introdução à educação alimentar”, lançam uma série de textos que relacionam conhecimentos científicos aos alimentos. O primeiro texto parte de um conhecimento popular para analisar o impacto de uma combinação alimentar na absorção de ferro pelo organismo.
POR QUE CHUPAR LARANJA APÓS COMER FEIJOADA?
Há diversos conhecimentos populares que relacionam laranja com feijoada. Mas, por que ingerir laranja após comer feijoada? Poderia ser outra fruta? A ingestão de laranja seria importante apenas quando se come feijoada?
Para responder, é necessário lembrar que o ferro (símbolo Fe) pode ser encontrado na natureza em três diferentes estados de oxidação: Fe0 (quando o átomo apresenta a mesma quantidade de prótons [cargas positivas] e elétrons [cargas negativas]); Fe2+ (2 elétrons a menos que a quantidade de prótons); e Fe3+ (3 elétrons a menos). Além disso, saber que nas carnes, o ferro pode ser encontrado associado a um grupo chamado heme [figura 1] e, por isso, é denominado ferro heme. Nas hemoglobinas e mioglobinas o ferro apenas quando na forma Fe2+ interage e possibilita o transporte do gás oxigênio no sangue. Uma alimentação deficiente em ferro poderia provocar anemia ferropriva.
Nos vegetais, o ferro é encontrado na forma Fe3+ e não está associado a grupos. Nos casos em que o ferro está numa forma livre, ele é denominado ferro não heme. Ferro não heme também pode ser encontrado em cereais matinais e ovos. Entre parênteses é apresentada a quantidade de ferro presente em 100g de alguns alimentos: peito de frango cozido sem pele (0,3mg); bisteca de porco grelhada (1mg); ovo (1,5mg); feijão preto cozido (1,5mg); contrafilé bovino cozido sem gordura (2,4mg).
A absorção do ferro heme é maior que a de ferro não heme (conforme os alimentos considerados, a absorção pode variar de 2 a 15 vezes). A composição da alimentação pode influenciar nessa absorção e o ferro precisar estar solubilizado na forma Fe2+ no intestino, cuja formação a partir de Fe3+ (presente no feijão) ocorre na presença de vitamina C [ácido ascórbico, figura 2], facilitadora da absorção. A vitamina C também pode formar um complexo ferro-ascorbato, o qual é solúvel no intestino e possibilita e aumenta a absorção de ferro pelo organismo. Entre parênteses é apresentada a quantidade de vitamina C presente em 100g de alguns alimentos: banana (10mg); laranja (47mg); couve (128mg); goiaba (302mg); pimentão verde (720mg).
Sendo assim, muitas combinações alimentares benéficas à absorção de ferro poderiam ser feitas, além da ingestão conjunta de feijão cozido e laranja.
| Figura 1: Estrutura química do grupo heme. | Figura 2: Estrutura química da vitamina C (ácido ascórbico). |
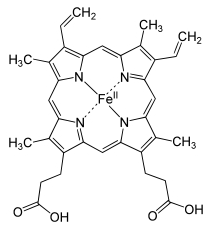 |
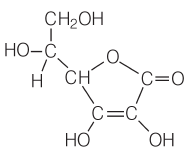 |
| Referência: SBQ (site abaixo). | Referência: Bibliografia 2. |
Bibliografia BORTOLINI, G.A.; FISBERG, M. Orientação nutricional do paciente com deficiência de ferro. Rev. Bras. de Hematologia e Hemoterapia, v.32, supl.2, p.105-113, 2010. FIORUCCI, A.R.; SOARES, M.H.F.B.; CAVALHEIRO, E.T.G. A importância da vitamina C na sociedade através dos tempos. Química Nova na Escola, n.17, p.3-7, 2003.
AUTORES
Tainá Maiara Farias Graduanda no Bacharelado em Ciência e Tecnologia pela Universidade Federal do ABC. Técnica em Química. Aluna de iniciação científica no Programa Pesquisando Desde o Primeiro Dia (PDPD) sob orientação do Prof. Dr. Paulo de Avila Junior.
Prof. Dr. Paulo de Avila Junior ( CCNH ) Licenciado e Bacharel em Química, Doutor em Ciências, área Bioquímica, com ênfase em educação científica, todos pelo Instituto de Química da Universidade de São Paulo. Coordena um subprojeto do PIBID/UFABC na área de Licenciatura em Química.
